原子の構造
A 原子の構造
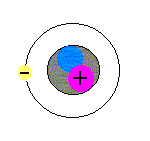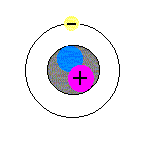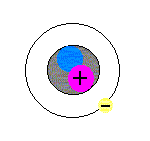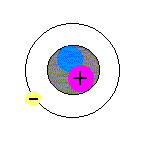
モデルを見ながら理解してください。
まず、原子は、中心に1個、原子核というものが存在します(図の+の赤い丸と青い丸を囲っている黒い丸)。原子核はとても小さく、直径が、原子全体の直径の約1万分の1です(原子核の直径は、約10-15〜10-14m)。
さらに、原子核は、正の電気をもついくつかの陽子と、正負どちらの電気ももたないいくつかの中性子(0個のときもある)からできています。この陽子と中性子の質量はほぼ同じです。
陽子のもつ正の電気量は1.60×10-19Cで、これは電気量の最小単位(つまり、一番小さい)であり、電気素量といいます。
次に、電子は、1.60×10-19Cの負の電気をもつ粒子です(図の原子核の周りを回っている丸)。電子と陽子のもつ電気量の絶対値は等しいのですが、符号が異なります。
1個の原子には、原子核中の陽子と同数の電子が含まれています。同数ということは、互いに正負の電気を打ち消しあうので、原子は電気的に中性であることがわかります。
電子の質量は、陽子・中性子の約1/1840程です(つまり、とても軽い)。よって、原子の質量の99.9%以上は、原子核の重さであることがわかります。
原子核中の陽子の数は、元素の種類によって異なります。この数を、その原子の原子番号といいます。また、原子核中の陽子と中性子の数の和を、その原子の質量数といいます。原子を、原子番号や質量数も含めて表す場合、次のようになります。
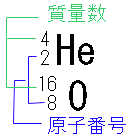
(例) ヘリウム原子と酸素原子
まとめ
陽子の質量=中性子の質量
陽子の数=電子の数=原子番号
質量数=陽子の数+中性子の数
原子の質量≒原子核の質量≒陽子1個の質量×質量数
B同位体
原子の中には、原子番号が同じ(=陽子の数が同じ)なのに、質量数が違う原子が存在します。これらをたがいに同位体(アイソトープ)といいます。陽子の数が同じなので、中性子の数だけが違う、ということです。
一般に同位体は、質量が異なるだけで、化学的性質はよく似ているので同じであると考えます。
さらに、同位体のうち、放射線を放つものを放射性同位体(ラジオアイソトープ)といいます。なぜ放射性を放つのかというと、たとえば炭素の同位体の場合、質量数が12および13の同位体は原子核が安定しているが、質量数が14の同位体の原子核は不安定で壊れやすく、このような同位体は原子核が壊れるときに放射線を出すことがわかっています。
同素体と同位体の違い
同素体…性質が違う⇔性質は同じ…同位体

モデルを見ながら理解してください。
まず、原子は、中心に1個、原子核というものが存在します(図の+の赤い丸と青い丸を囲っている黒い丸)。原子核はとても小さく、直径が、原子全体の直径の約1万分の1です(原子核の直径は、約10-15〜10-14m)。
さらに、原子核は、正の電気をもついくつかの陽子と、正負どちらの電気ももたないいくつかの中性子(0個のときもある)からできています。この陽子と中性子の質量はほぼ同じです。
陽子のもつ正の電気量は1.60×10-19Cで、これは電気量の最小単位(つまり、一番小さい)であり、電気素量といいます。
| 【参考】 電気量について 電気量[C]=電流[A]×時間[s] 電子1個のもつ電気量は1.602×10-19[C] (詳しくは3学期に) |
次に、電子は、1.60×10-19Cの負の電気をもつ粒子です(図の原子核の周りを回っている丸)。電子と陽子のもつ電気量の絶対値は等しいのですが、符号が異なります。
1個の原子には、原子核中の陽子と同数の電子が含まれています。同数ということは、互いに正負の電気を打ち消しあうので、原子は電気的に中性であることがわかります。
電子の質量は、陽子・中性子の約1/1840程です(つまり、とても軽い)。よって、原子の質量の99.9%以上は、原子核の重さであることがわかります。
原子核中の陽子の数は、元素の種類によって異なります。この数を、その原子の原子番号といいます。また、原子核中の陽子と中性子の数の和を、その原子の質量数といいます。原子を、原子番号や質量数も含めて表す場合、次のようになります。

(例) ヘリウム原子と酸素原子
まとめ
陽子の質量=中性子の質量
陽子の数=電子の数=原子番号
質量数=陽子の数+中性子の数
原子の質量≒原子核の質量≒陽子1個の質量×質量数
B
原子の中には、原子番号が同じ(=陽子の数が同じ)なのに、質量数が違う原子が存在します。これらをたがいに同位体(アイソトープ)といいます。陽子の数が同じなので、中性子の数だけが違う、ということです。
一般に同位体は、質量が異なるだけで、化学的性質はよく似ているので同じであると考えます。
さらに、同位体のうち、放射線を放つものを放射性同位体(ラジオアイソトープ)といいます。なぜ放射性を放つのかというと、たとえば炭素の同位体の場合、質量数が12および13の同位体は原子核が安定しているが、質量数が14の同位体の原子核は不安定で壊れやすく、このような同位体は原子核が壊れるときに放射線を出すことがわかっています。
同素体と同位体の違い
同素体…性質が違う⇔性質は同じ…同位体
br→
main_box