原子の電子配置
A 原子の電子配置
原子核の周りには、電子殻とよばれるいくつかの層があります。
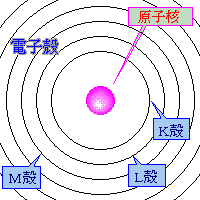 ボーアの原子モデル
ボーアの原子モデル 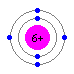 C原子
C原子
この電子殻中に、電子が存在します。
電子殻は、内側から順に、K殻・L殻・M殻・N殻…とよばれます。
各電子殻によって、収容できる電子の数には限度があり、K殻から順に、2個・8個・18個・32個…と決まっています。これを一般的に表すと、内側からn番目の殻の電子の最大収容数は2n2個となります。
次に、教科書のP27の、表6「原子の電子配置」を見てみてください。
K殻は2個まで電子が入ります。L殻は最大で8個入ります。ここまでは普通です。
しかし、次のM殻は最大で18個入るはずですが、表には最大で8個までしか電子が収容されていません。
詳しくは、希ガスの電子配置を見たあとで解説します。
電子配置…電子の配列のしかた。
B価電子
最も外側の電子殻(最外殻)にある電子を、最外殻電子といいます。最外殻電子の数が1〜7個のとき、その最外殻電子のことを価電子といいます。この価電子の数は、その原子の化学的性質を表すので、価電子の数が同じ原子どうしはよく似た性質を示します。
では、最外殻電子の数が8個の場合はどうでしょうか。
最外殻電子の数が8個になるのは、きまって希ガス原子です。
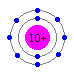 Ne原子
Ne原子 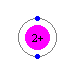 He原子(2個の電子は、価電子ではない)
He原子(2個の電子は、価電子ではない)
実は、この希ガス原子というものは、とても安定した構造になっています。つまり、最外殻電子の数が8個であることは、構造上、とても安定しているのです。
だから、さきほどの電子配置のほうで、最大収容数にはまだ余裕があるにもかかわらず電子が8個までしか収容されなかったのは、原子が安定した状態でいようとするために、殻を閉じて次の殻へ電子を配置させるのです。
閉殻…最大数の電子が収容された電子殻。
(例)
HeのK殻 NeのL殻
原子核の周りには、電子殻とよばれるいくつかの層があります。
 ボーアの原子モデル
ボーアの原子モデル  C原子
C原子この電子殻中に、電子が存在します。
電子殻は、内側から順に、K殻・L殻・M殻・N殻…とよばれます。
各電子殻によって、収容できる電子の数には限度があり、K殻から順に、2個・8個・18個・32個…と決まっています。これを一般的に表すと、内側からn番目の殻の電子の最大収容数は2n2個となります。
次に、教科書のP27の、表6「原子の電子配置」を見てみてください。
K殻は2個まで電子が入ります。L殻は最大で8個入ります。ここまでは普通です。
しかし、次のM殻は最大で18個入るはずですが、表には最大で8個までしか電子が収容されていません。
詳しくは、希ガスの電子配置を見たあとで解説します。
電子配置…電子の配列のしかた。
B
最も外側の電子殻(最外殻)にある電子を、最外殻電子といいます。最外殻電子の数が1〜7個のとき、その最外殻電子のことを価電子といいます。この価電子の数は、その原子の化学的性質を表すので、価電子の数が同じ原子どうしはよく似た性質を示します。
では、最外殻電子の数が8個の場合はどうでしょうか。
最外殻電子の数が8個になるのは、きまって希ガス原子です。
 Ne原子
Ne原子  He原子(2個の電子は、価電子ではない)
He原子(2個の電子は、価電子ではない)実は、この希ガス原子というものは、とても安定した構造になっています。つまり、最外殻電子の数が8個であることは、構造上、とても安定しているのです。
だから、さきほどの電子配置のほうで、最大収容数にはまだ余裕があるにもかかわらず電子が8個までしか収容されなかったのは、原子が安定した状態でいようとするために、殻を閉じて次の殻へ電子を配置させるのです。
閉殻…最大数の電子が収容された電子殻。
(例)
HeのK殻 NeのL殻
br→
main_box