原子の結びつき
A イオンの生成とイオン結合
希ガスの電子配置に近い原子は、電子を得たり失ったりしやすい(第2節でも述べたように、安定した電子配置になろうとするため)ので、イオンになりやすくなります。
どこかで解説しましたが、電子とは、負の電気をもったものです。つまり、電子を受け取るということは、陰イオンになるということを示します。
反対に、電子を放出して希ガスの電子配置に近づこうとすれば、陽イオンになるということを示します。
1族、2族あたりの原子はとくに、電子を放出して陽イオンになりやすいです。
逆に、16族、17族あたりの原子は、電子を受け取って陰イオンになりやすいです。
イオン化エネルギー…原子から電子を1個取り去って、陽イオンにするときに必要な
最小のエネルギー。
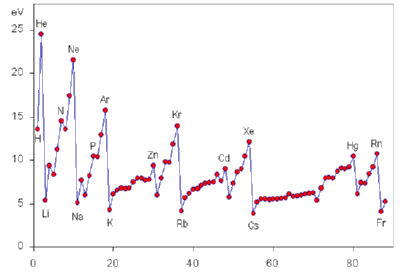
この、イオン化エネルギーが小さい原子ほど、陽イオンになりやすいです。
電子親和力…原子が最外殻に電子1個を受け取って陰イオンになるとき、
放出するエネルギー。
なんかこれ、テスト出たような気がするので覚えておいた方が良い気がします。
原子やイオンの結びつきを化学結合といいます。
(例)塩化ナトリウム
NaCl…Naは1価の陽イオンで、Clは1価の陰イオンである。
この2つが、静電気的な引力で結合している。
この例のように、陽イオンと陰イオンの静電気的な引力による結びつきを、イオン結合といいます。
正の電荷をもつイオンと、負の電荷をもつイオンは、必ず電気的に中性になるように結合し、イオン結晶を形成するようになっています。つまり、正・負のの電気量がそれぞれ等しい、陽イオンの価数と陰イオンの価数が等しいように結合する、ということです。
(例)塩化マグネシウム
MgCl2…Mgは2価の陽イオンで、Clは1価の陰イオンである。
→電気的に中性になるように、原子の数を調整する。
→Mg×1=Cl×2⇒MgCl2
多数の陽イオンと陰イオンが結合してできた結晶をイオン結晶といいます。
特徴
融点や沸点の高いものが多い。
硬いがもろく、強くたたくと割れやすい。
水に溶けやすいものが多い。
固体では電気を通さないが、液体や水溶液では電気を通す。
B共有結合と分子
原子間で出し合った価電子を共有しあう結合を、共有結合といいます。
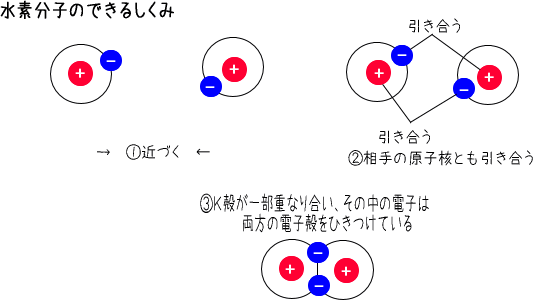
重なり合った電子殻の中では、水素原子それぞれの価電子が対になります。これを電子対といいます。対になった2個の電子は、両方の水素原子の原子核に共有されます。また、各水素原子は、安定なヘリウム原子と同じような電子配置になります。
また、対になっていない電子を不対電子、共有されている電子対を共有電子対といいます。
これを、次のようにして表現したものを、電子式といいます。
H:H
(不対電子 + 不対電子 → 共有電子対)
H・ H・ H:H
Hの横にくっついている・は、価電子です。よって、:は共有電子対であることがわかります。
(例)
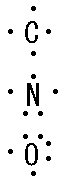
さらに、これを次のように表現したものを、構造式といいます。
H−H
Hの横にくっついている−は価標といって、1組の共有電子対を表します。これが=となれば二重結合、≡であれば三重結合であることがわかります。
また、1つの原子がもつ価標の数を、その原子の原子価といい、共有結合に使われる価電子の数に等しくなります。
(例)二酸化炭素分子 モデル
・ ・・
Cは、・C・ 、Oは・O・ CO2
・ ・・ ・・ ・・
よって電子式は O::C::O
・・ ・・
構造式は、 O=C=O
C金属の結合
自由電子…重なり合った電子殻を自由に動き回ることができる電子。
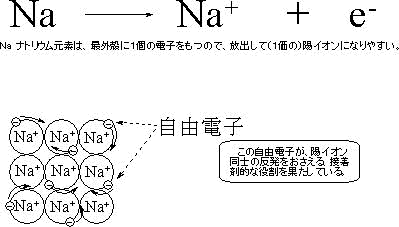
また、この自由電子による金属元素の結合を金属結合といいます。
展性…箔のように薄く広がる性質。
延性…針金のように細く伸びる性質。
希ガスの電子配置に近い原子は、電子を得たり失ったりしやすい(第2節でも述べたように、安定した電子配置になろうとするため)ので、イオンになりやすくなります。
どこかで解説しましたが、電子とは、負の電気をもったものです。つまり、電子を受け取るということは、陰イオンになるということを示します。
反対に、電子を放出して希ガスの電子配置に近づこうとすれば、陽イオンになるということを示します。
1族、2族あたりの原子はとくに、電子を放出して陽イオンになりやすいです。
逆に、16族、17族あたりの原子は、電子を受け取って陰イオンになりやすいです。
イオン化エネルギー…原子から電子を1個取り去って、陽イオンにするときに必要な
最小のエネルギー。

この、イオン化エネルギーが小さい原子ほど、陽イオンになりやすいです。
電子親和力…原子が最外殻に電子1個を受け取って陰イオンになるとき、
放出するエネルギー。
なんかこれ、テスト出たような気がするので覚えておいた方が良い気がします。
原子やイオンの結びつきを化学結合といいます。
(例)塩化ナトリウム
NaCl…Naは1価の陽イオンで、Clは1価の陰イオンである。
この2つが、静電気的な引力で結合している。
この例のように、陽イオンと陰イオンの静電気的な引力による結びつきを、イオン結合といいます。
正の電荷をもつイオンと、負の電荷をもつイオンは、必ず電気的に中性になるように結合し、イオン結晶を形成するようになっています。つまり、正・負のの電気量がそれぞれ等しい、陽イオンの価数と陰イオンの価数が等しいように結合する、ということです。
(例)塩化マグネシウム
MgCl2…Mgは2価の陽イオンで、Clは1価の陰イオンである。
→電気的に中性になるように、原子の数を調整する。
→Mg×1=Cl×2⇒MgCl2
多数の陽イオンと陰イオンが結合してできた結晶をイオン結晶といいます。
特徴
融点や沸点の高いものが多い。
硬いがもろく、強くたたくと割れやすい。
水に溶けやすいものが多い。
固体では電気を通さないが、液体や水溶液では電気を通す。
B
原子間で出し合った価電子を共有しあう結合を、共有結合といいます。

重なり合った電子殻の中では、水素原子それぞれの価電子が対になります。これを電子対といいます。対になった2個の電子は、両方の水素原子の原子核に共有されます。また、各水素原子は、安定なヘリウム原子と同じような電子配置になります。
また、対になっていない電子を不対電子、共有されている電子対を共有電子対といいます。
これを、次のようにして表現したものを、電子式といいます。
H:H
(不対電子 + 不対電子 → 共有電子対)
H・ H・ H:H
Hの横にくっついている・は、価電子です。よって、:は共有電子対であることがわかります。
(例)
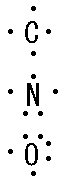
さらに、これを次のように表現したものを、構造式といいます。
H−H
Hの横にくっついている−は価標といって、1組の共有電子対を表します。これが=となれば二重結合、≡であれば三重結合であることがわかります。
また、1つの原子がもつ価標の数を、その原子の原子価といい、共有結合に使われる価電子の数に等しくなります。
(例)二酸化炭素分子 モデル
・ ・・

Cは、・C・ 、Oは・O・ CO2
・ ・・ ・・ ・・
よって電子式は O::C::O
・・ ・・
構造式は、 O=C=O
C
自由電子…重なり合った電子殻を自由に動き回ることができる電子。

また、この自由電子による金属元素の結合を金属結合といいます。
展性…箔のように薄く広がる性質。
延性…針金のように細く伸びる性質。
br→
main_box