巁偲墫婎
俙丂巁偲墫婎偺惈幙
巁惈丗惵怓儕僩儅僗巻傪愒怓偵曄偊傞丅巁惈傪帵偡暔幙傪巁偲偄偆丅俫+傪傪惗偠傞丅
丂丂丂丂丂悈慺僀僆儞偼丄悈梟塼拞偱偼悈暘巕偲寢傃偮偄偨忬懺偱懚嵼偡傞丅
丂丂丂丂丂偙傟傪僆僉僜僯僂儉僀僆儞乮俫3俷+乯偲偄偆丅
墫婎惈乮傾儖僇儕惈乯丗愒怓儕僩儅僗巻傪惵怓偵曄偊丄巁偲斀墳偟偰偦偺惈幙傪懪偪
丂丂丂丂丂丂丂丂丂丂丂丂丂 徚偡丅俷俫-傪惗偠傞丅
仠巁丒墫婎偺掕媊
傾儗僯僂僗偺掕媊
丂丂丂巁偼俫+傪弌偡暔幙丄墫婎偼俷俫-傪弌偡暔幙
<椺>
丂俫俠倢仺俫+亄俠倢-丂丂丂丂丂俶倎俷俫仺俶倎+亄俷俫-
丂乮巁乯丂丂丂丂丂丂丂丂丂丂丂丂丂丂乮墫婎乯
僽儗儞僗僥僢僪丒儘乕儕乕偺掕媊
丂丂丂巁偼俫+傪梌偊傞暔幙丄墫婎偼俫+傪庴偗庢傞暔幙
<椺>
丂俠俫3俠俷俷俫亄俫2俷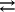 俠俫3俠俷俷-亄俫3俷+
俠俫3俠俷俷-亄俫3俷+
丂丂丂丂乮巁乯丂丂丂丂 乮墫婎乯
俛丂巁丒墫婎偺壙悢
巁丒墫婎侾mol偑揹棧偟偨偲偒惗偠傞俫+傑偨偼俷俫-偺暔幙検乮mol悢乯傪丄偦偺巁丒墫婎偺壙悢偲偄偆丅
<椺>丂棸巁
丂俫2俽俷4仺俀俫+亄俽俷42-
丂侾mol偺棸巁偐傜俀mol偺俫+偑惗偠偨仺棸巁偼俀壙偺巁
俠丂巁丒墫婎偺嫮偝
揹棧搙丗揹棧偡傞妱崌丅偙偺揹棧搙偺戝彫偱巁丒墫婎偺嫮庛偑寛傑傞丅
丂丂丂丂丂丂揹棧搙偑傎傏侾偱偁傞巁丒墫婎傪嫮巁丒嫮墫婎偲偄偄丄
丂丂丂丂丂丂侾傛傝偐側傝彫偝偄巁丒墫婎傪庛巁丒庛墫婎偲偄偆丅
丂丂丂丂丂丂
巁惈丗惵怓儕僩儅僗巻傪愒怓偵曄偊傞丅巁惈傪帵偡暔幙傪巁偲偄偆丅俫+傪傪惗偠傞丅
丂丂丂丂丂悈慺僀僆儞偼丄悈梟塼拞偱偼悈暘巕偲寢傃偮偄偨忬懺偱懚嵼偡傞丅
丂丂丂丂丂偙傟傪僆僉僜僯僂儉僀僆儞乮俫3俷+乯偲偄偆丅
墫婎惈乮傾儖僇儕惈乯丗愒怓儕僩儅僗巻傪惵怓偵曄偊丄巁偲斀墳偟偰偦偺惈幙傪懪偪
丂丂丂丂丂丂丂丂丂丂丂丂丂 徚偡丅俷俫-傪惗偠傞丅
| 巁丒墫婎偺椺 | 仸2擭惗偼埫婰偟偰偍偔偙偲 |
| 巁 | 墫婎 |
| 仠侾壙偺巁 丂墫巁丗俫俠倢仺俫+亄俠倢-丂丂丂 丂徤巁丗俫俶俷3仺俫+亄俶俷3-丂 丂恷巁丗俠俫3俠俷俷俫 |
仠侾壙偺墫婎 丂悈巁壔僫僩儕僂儉丗俶倎俷俫仺俶倎+亄俷俫- 丂悈巁壔僇儕僂儉丗俲俷俫仺俲+亄俷俫- 丂傾儞儌僯傾悈丗俶俫3亄俫2俷 |
| 仠俀壙偺巁乧2抜奒揹棧 丂棸巁丗俫2俽俷4仺俀俫+亄俽俷42- 丂棸壔悈慺丗俫2俽 丂擇巁壔扽慺丗俠俷2亄俫2俷 |
仠俀壙偺墫婎 丂悈巁壔僇儖僔僂儉丗俠倎乮俷俫乯2仺俠倎2+亄俀俷俫- 丂悈巁壔僶儕僂儉丗俛倎乮俷俫乯2仺俛倎2+亄俀俷俫- 丂悈巁壔儅僌僱僔僂儉丄悈巁壔摵乮嘦乯傕摨偠 |
| 仠俁壙偺巁乧3抜奒揹棧 丂儕儞巁丗俫3俹俷4 |
仠俁壙偺墫婎 丂悈巁壔傾儖儈僯僂儉丗俙倢乮俷俫乯3 丂悈巁壔揝乮嘨乯丗俥倕乮俷俫乯3 |
仠巁丒墫婎偺掕媊
傾儗僯僂僗偺掕媊
丂丂丂巁偼俫+傪弌偡暔幙丄墫婎偼俷俫-傪弌偡暔幙
<椺>
丂俫俠倢仺俫+亄俠倢-丂丂丂丂丂俶倎俷俫仺俶倎+亄俷俫-
丂乮巁乯丂丂丂丂丂丂丂丂丂丂丂丂丂丂乮墫婎乯
僽儗儞僗僥僢僪丒儘乕儕乕偺掕媊
丂丂丂巁偼俫+傪梌偊傞暔幙丄墫婎偼俫+傪庴偗庢傞暔幙
<椺>
丂俠俫3俠俷俷俫亄俫2俷
丂丂丂丂乮巁乯丂丂丂丂 乮墫婎乯
俛丂
巁丒墫婎侾mol偑揹棧偟偨偲偒惗偠傞俫+傑偨偼俷俫-偺暔幙検乮mol悢乯傪丄偦偺巁丒墫婎偺壙悢偲偄偆丅
<椺>丂棸巁
丂俫2俽俷4仺俀俫+亄俽俷42-
丂侾mol偺棸巁偐傜俀mol偺俫+偑惗偠偨仺棸巁偼俀壙偺巁
俠丂
揹棧搙丗揹棧偡傞妱崌丅偙偺揹棧搙偺戝彫偱巁丒墫婎偺嫮庛偑寛傑傞丅
丂丂丂丂丂丂揹棧搙偑傎傏侾偱偁傞巁丒墫婎傪嫮巁丒嫮墫婎偲偄偄丄
丂丂丂丂丂丂侾傛傝偐側傝彫偝偄巁丒墫婎傪庛巁丒庛墫婎偲偄偆丅
丂丂丂丂丂丂
| 巁 | 墫婎 | |
| 嫮 | 摿偵傛偔弌戣偝傟傞偺偼師偺俁偮偱偁傞 墫巁丗俫俠倢 徤巁丗俫俶俷3 棸巁丗俫2俽俷4 |
傾儖僇儕嬥懏丄傾儖僇儕搚椶嬥懏偺悈巁壔暔 悈巁壔僫僩儕僂儉丗俶倎俷俫 悈巁壔僇儕僂儉丗俲俷俫 悈巁壔僇儖僔僂儉丗俠倎乮俷俫乯2 |
| 庛 | 忋婰偺俁偮埲奜偑傎偲傫偳 恷巁丗俠俫3俠俷俷俫 擇巁壔扽慺丗俠俷2亄俫2俷 棸壔悈慺丗俫2俽 |
傾儖僇儕嬥懏丄傾儖僇儕搚椶嬥懏埲奜偺悈巁壔暔 傾儞儌僯傾悈丗俶俫3 aq 悈巁壔摵乮嘦乯丗俠倳乮俷俫乯2 |
br仺
main_box