水の電離とpH
A 水の電離
H2O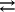 H++OH-
H++OH-
このとき、H+とOH-のモル濃度は等しく、25℃では1.0×10-7mol/Lであり、この状態を中性という。
また、化学ではモル濃度をあらわす記号として[ ]を用いる。
[H+]=[OH-]=1.0×10-7[mol/L] (25℃)
水のイオン積
[H+]と[OH-]の積は水のイオン積とよばれる。すなわち、
水のイオン積Kw=[H+][OH-]=1.0×10-14(mol/L)2
BpH
pH:水素イオン指数
pOH:水酸化イオン指数
●公式
[H+]=10-x[mol/L]のとき、pH=x
pH=−log[H+]
pOH=−log[OH-]
∴pH+pOH=14
pHの値がnだけ小さくなると、[H+]は10n倍になる。
●酸・塩基の濃度と電離度α (1価の酸・塩基の場合)
水素イオン濃度[H+]=酸の濃度[mol/l]×電離度α
水酸化物イオン濃度[OH-]=塩基の濃度[mol/l]×電離度α
C指示薬とpH測定
中和点を調べるものとして、指示薬が必要である。種類はいろいろあるが、入試で出題される指示薬はフェノールフタレインとメチルオレンジのほぼ2つのみ。指示薬の名前、色の変化、そのときのpHの数値(大まかでよい)をおさえること。
●フェノールフタレイン
無色 8.3←―――→9.8 赤色
中和点:塩基性
弱酸と強塩基の中和で使える。
●メチルオレンジ
赤色 3.1←―――→4.4 黄色
中和点:酸性
強酸と弱塩基の中和で使える。
◎両方使用可能
中和点:中性
強酸と強塩基の中和で使える。
H2O
このとき、H+とOH-のモル濃度は等しく、25℃では1.0×10-7mol/Lであり、この状態を中性という。
また、化学ではモル濃度をあらわす記号として[ ]を用いる。
[H+]=[OH-]=1.0×10-7[mol/L] (25℃)
水のイオン積
[H+]と[OH-]の積は水のイオン積とよばれる。すなわち、
水のイオン積Kw=[H+][OH-]=1.0×10-14(mol/L)2
B
pH:水素イオン指数
pOH:水酸化イオン指数
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| [H+] | 10-1 | 10-2 | 10-3 | 10-4 | 10-5 | 10-6 | 10-7 | 10-8 | 10-9 | 10-10 | 10-11 | 10-12 | 10-13 |
| pOH | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| [OH-] | 10-13 | 10-12 | 10-11 | 10-10 | 10-9 | 10-8 | 10-7 | 10-6 | 10-5 | 10-4 | 10-3 | 10-2 | 10-1 |
●公式
[H+]=10-x[mol/L]のとき、pH=x
pH=−log[H+]
pOH=−log[OH-]
∴pH+pOH=14
pHの値がnだけ小さくなると、[H+]は10n倍になる。
●酸・塩基の濃度と電離度α (1価の酸・塩基の場合)
水素イオン濃度[H+]=酸の濃度[mol/l]×電離度α
水酸化物イオン濃度[OH-]=塩基の濃度[mol/l]×電離度α
C
中和点を調べるものとして、指示薬が必要である。種類はいろいろあるが、入試で出題される指示薬はフェノールフタレインとメチルオレンジのほぼ2つのみ。指示薬の名前、色の変化、そのときのpHの数値(大まかでよい)をおさえること。
●フェノールフタレイン
無色 8.3←―――→9.8 赤色
中和点:塩基性
弱酸と強塩基の中和で使える。
●メチルオレンジ
赤色 3.1←―――→4.4 黄色
中和点:酸性
強酸と弱塩基の中和で使える。
◎両方使用可能
中和点:中性
強酸と強塩基の中和で使える。
br→
main_box