中和反応
A 酸・塩基の中和
中和反応:酸と塩基から塩と水を生じる反応、または酸から生じる水素イオンH+と、
塩基から生じる水酸化物イオンOH-から、水H2Oが生じる反応。
<例>
H2SO4+2NaOH→Na2SO4+2H2O
塩:酸の陰イオンと塩基の陽イオンからなる化合物。
B中和適定
中和適定:中和反応を利用して、濃度のわかっていない酸(または塩基)の水溶液の
濃度を求める操作。
<例>
H2SO4+2NaOH→Na2SO4+2H2O
1mol 2mol 1mol 2mol
酸と塩基がちょうど中和するとき、次の関係が成り立つ。
(酸の価数)×(酸の物質量)=(塩基の価数)×(塩基の物質量)
この式は、次のように書き換えられる。
(酸の価数)×(酸のモル濃度[mol/l])×((酸の体積[cm3])/1000)
=(塩基の価数)×(塩基のモル濃度[mol/l])×((塩基の体積[cm3]/1000)
適定実験器具
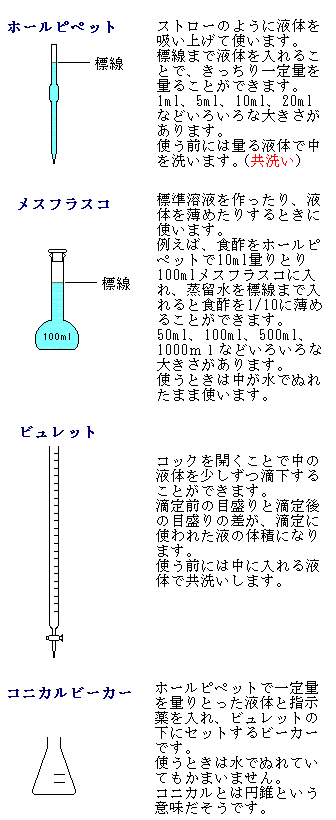
きっかり体積を量るメスフラスコ、ホールピペット、ビュレットは加熱乾燥してはいけない。
(ガラスが熱で膨張してしまう)
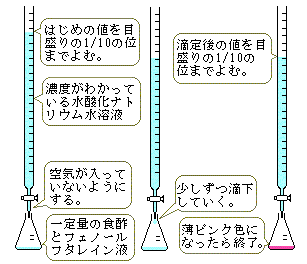
食酢と水酸化ナトリウム水溶液の中和滴定
C適定曲線
適定曲線:中和反応の際、加えた酸・塩基の体積と混合溶液のpHの関係を表した
グラフ。中和点付近でほぼ垂直(pHが大きく変化)になる。
あとは教科書見てw
D中和点の液性
中和点での溶液の液性は、必ずしも「中性」であるとは限らない。
中和点では「塩+水」。ゆえに、以下のことがいえる。
・強酸+強塩基⇒中性
・強酸+弱塩基⇒酸性
・弱酸+強塩基⇒塩基性
●塩の種類
・正塩:塩の中に、HとOHが残っていないもの。
NaCl、CH3COONa など
・酸性塩:塩の中に、Hが残っているもの。
NaHCO3、KHSO4、NaH2PO4 など
・塩基性塩:塩の中に、OHが残っているもの。
Mg(OH)Cl、Cu(OH)NO3 など
中和反応:酸と塩基から塩と水を生じる反応、または酸から生じる水素イオンH+と、
塩基から生じる水酸化物イオンOH-から、水H2Oが生じる反応。
<例>
H2SO4+2NaOH→Na2SO4+2H2O
塩:酸の陰イオンと塩基の陽イオンからなる化合物。
B
中和適定:中和反応を利用して、濃度のわかっていない酸(または塩基)の水溶液の
濃度を求める操作。
<例>
H2SO4+2NaOH→Na2SO4+2H2O
1mol 2mol 1mol 2mol
酸と塩基がちょうど中和するとき、次の関係が成り立つ。
(酸の価数)×(酸の物質量)=(塩基の価数)×(塩基の物質量)
この式は、次のように書き換えられる。
(酸の価数)×(酸のモル濃度[mol/l])×((酸の体積[cm3])/1000)
=(塩基の価数)×(塩基のモル濃度[mol/l])×((塩基の体積[cm3]/1000)
適定実験器具

きっかり体積を量るメスフラスコ、ホールピペット、ビュレットは加熱乾燥してはいけない。
(ガラスが熱で膨張してしまう)
食酢と水酸化ナトリウム水溶液の中和滴定

C
適定曲線:中和反応の際、加えた酸・塩基の体積と混合溶液のpHの関係を表した
グラフ。中和点付近でほぼ垂直(pHが大きく変化)になる。
あとは教科書見てw
D
中和点での溶液の液性は、必ずしも「中性」であるとは限らない。
中和点では「塩+水」。ゆえに、以下のことがいえる。
・強酸+強塩基⇒中性
・強酸+弱塩基⇒酸性
・弱酸+強塩基⇒塩基性
●塩の種類
・正塩:塩の中に、HとOHが残っていないもの。
NaCl、CH3COONa など
・酸性塩:塩の中に、Hが残っているもの。
NaHCO3、KHSO4、NaH2PO4 など
・塩基性塩:塩の中に、OHが残っているもの。
Mg(OH)Cl、Cu(OH)NO3 など
br→
main_box