熱と温度
Point1 基礎事項
気体を容器に入れると、どのような形をした容器でも瞬時に気体は容器全体に広がる。これは、気体分子が自由活発に動き回っているためと考えられる。液体や固体の場合も気体ほど自由ではないが、それぞれの分子は絶えず運動をしており、このような運動を分子の 熱運動 という。
温度は熱運動の激しさを表す量である。
セ氏(セルシウス)温度t:[℃]
絶対温度T:[K]
絶対零度 0[K]=−273.15[℃]
・絶対温度の算出法
T=t+273.15
熱容量C:1[K]温度を下げるのに必要な熱量。
式 C=加えた熱量Q/温度変化ΔT[J/K]
比熱c:物質の性質を表す単位量(質量)あたりの熱容量。
式 c=熱容量C/質量m=Q/mΔT[J/g・K]
※熱の単元では例外的にSi単位系から外れて、kgではなくgを使う。
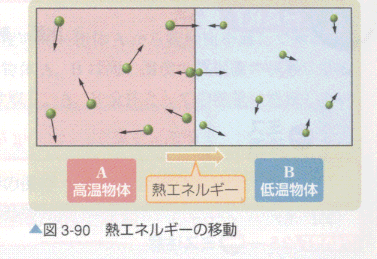
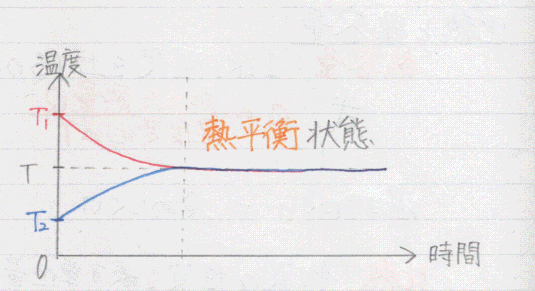
高温の物体が失った質量=低音の物体が得た熱量⇒熱量の保存
Point2例題
熱容量126J/Kの水熱量計に、20.0℃の水150gが入っている。この中に80.0℃に温められた質量100gの鉄の塊を入れたところ、温度は23.4℃で一定となった。鉄の比熱はいくらか。3桁の数値で答えよ。ただし、水の比熱を4.20J/g・Kとする。
Point3 解答
鉄の比熱をc[J/g・K]とすると、鉄の塊の失った熱量は 100c(80.0−23.4)
熱量計と水の得た熱量は (126+4.20×150)×(23.4−20.0)
熱量の保存から 100c(80.0−23.4)=(126+630)×(23.4−20.0)
∴c=0.454[J/g・K]
気体を容器に入れると、どのような形をした容器でも瞬時に気体は容器全体に広がる。これは、気体分子が自由活発に動き回っているためと考えられる。液体や固体の場合も気体ほど自由ではないが、それぞれの分子は絶えず運動をしており、このような運動を分子の 熱運動 という。
温度は熱運動の激しさを表す量である。
セ氏(セルシウス)温度t:[℃]
絶対温度T:[K]
絶対零度 0[K]=−273.15[℃]
・絶対温度の算出法
T=t+273.15
熱容量C:1[K]温度を下げるのに必要な熱量。
式 C=加えた熱量Q/温度変化ΔT[J/K]
比熱c:物質の性質を表す単位量(質量)あたりの熱容量。
式 c=熱容量C/質量m=Q/mΔT[J/g・K]
※熱の単元では例外的にSi単位系から外れて、kgではなくgを使う。


高温の物体が失った質量=低音の物体が得た熱量⇒熱量の保存
Point2
熱容量126J/Kの水熱量計に、20.0℃の水150gが入っている。この中に80.0℃に温められた質量100gの鉄の塊を入れたところ、温度は23.4℃で一定となった。鉄の比熱はいくらか。3桁の数値で答えよ。ただし、水の比熱を4.20J/g・Kとする。
Point3
鉄の比熱をc[J/g・K]とすると、鉄の塊の失った熱量は 100c(80.0−23.4)
熱量計と水の得た熱量は (126+4.20×150)×(23.4−20.0)
熱量の保存から 100c(80.0−23.4)=(126+630)×(23.4−20.0)
∴c=0.454[J/g・K]
br→
main_box