中和反応(中和適定)とpH
1 結果・まとめ
◎中和適定に関して
(1)シュウ酸のモル濃度
シュウ酸の質量 0.5993 g
シュウ酸のモル濃度 0.0475 mol/l
(2)NaOH溶液のモル濃度
NaOH溶液の適下量(対シュウ酸溶液)
1回目: 11.00 ml
2回目: 10.20 ml
3回目: 10.25 ml
4回目: 10.30 ml
5回目: (なし) ml 平均適下量: 10.23 ml
○NaOH溶液のモル濃度を計算しなさい。
(計算式)
2×(0.04753×10)/1000=1×x×(10.23/1000)
x=0.09292...≒0.0929 NaOH溶液の濃度: 0.0929 mol/l
(3)10倍希釈の食酢のモル濃度
NaOH溶液の適下量(対食酢)
1回目: 7.00 ml
2回目: 7.87 ml
3回目: 7.83 ml 近似値の平均(データとして使ったものには○印をする)
4回目: 7.80 ml
5回目: (なし) ml 平均適下量: 7.80 ml
○10倍希釈食酢溶液のモル濃度を計算しなさい。(有効数字3桁で)
(計算式)
1×(0.09292×7.80)/1000=1×(y×10)/1000
y=0.07247...≒0.0725 10倍希釈食酢溶液の濃度: 0.0725 mol/l
(4)(3)の値より、元の食酢のモル濃度を求めなさい。
(計算式)
0.0725×10=0.725 0.725 mol/l
(5)元の食酢の密度を1.01g/mlとしたとき、食酢中の酢酸の重量パーセント濃度を求めなさい。
(60.05×0.725)/(1.01×1000)=0.043105...
0.043105...×100=4.31 4.31 %
問題
(1)1.2mol/lの塩酸20mlを、0.4mol/lの水酸化カルシウム水溶液で中和するには何ml必要か。
1×1.12×20/1000=2×0.4×x/1000
x=30 30 ml
(2)2.4mol/lの塩酸の密度は1.06g/cm3である。質量パーセント濃度を求めなさい。H=1,Cl=35.5 (小数第2位を四捨五入し、小数第1位で答えなさい)
(2.4×36.5)/(1.06×1000)=0.08264...×100=…≒8.3 8.3 %
◎適定曲線に関して
(1)略。表の数値をそのままグラフにプロットして線を引いてグラフを完成させるだけ。
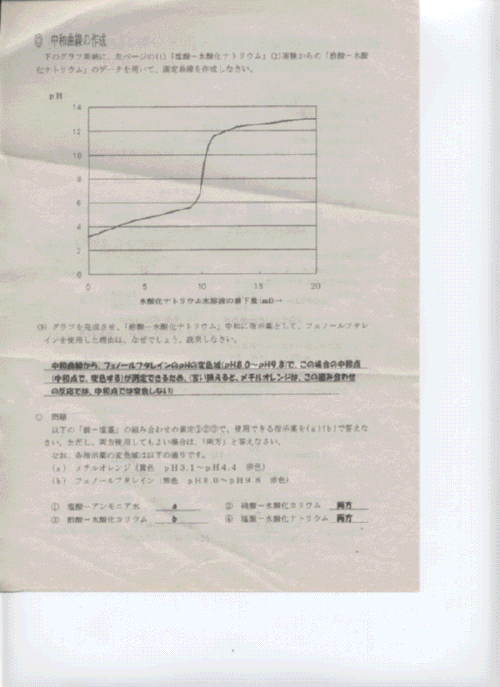
(2)(1)に同じ。
(3)グラフを完成させ、「酢酸-水酸化ナトリウム」中和に指示薬としてフェノールフタレインを使用した理由は何故でしょう。説明しなさい。
フェノールフタレインはpH8.4~9.8で赤色になり、酢酸-水酸化ナトリウムの中和点がおよそpH8.4~9.6の間にあるから。
○問題
以下の「塩-塩基」の組み合わせの適定①②③④で、使用できる指示薬を(a)(b)で答えなさい。ただし、両方使用してもよい場合は「両方」と答えなさい。
なお、各指示薬の変色域は以下の通りです。
(a)メチルオレンジ(黄色 pH3.1~pH4.4 赤色)
(b)フェノールフタレイン(無色 pH8.0~pH9.8 赤色)
①塩酸-アンモニア水…a ②硝酸-水酸化カリウム…両方
③酢酸-水酸化カリウム…b ④塩酸-水酸化ナトリウム…両方
◎中和適定に関して
(1)シュウ酸のモル濃度
シュウ酸の質量 0.5993 g
シュウ酸のモル濃度 0.0475 mol/l
(2)NaOH溶液のモル濃度
NaOH溶液の適下量(対シュウ酸溶液)
1回目: 11.00 ml
2回目: 10.20 ml
3回目: 10.25 ml
4回目: 10.30 ml
5回目: (なし) ml 平均適下量: 10.23 ml
○NaOH溶液のモル濃度を計算しなさい。
(計算式)
2×(0.04753×10)/1000=1×x×(10.23/1000)
x=0.09292...≒0.0929 NaOH溶液の濃度: 0.0929 mol/l
(3)10倍希釈の食酢のモル濃度
NaOH溶液の適下量(対食酢)
1回目: 7.00 ml
2回目: 7.87 ml
3回目: 7.83 ml 近似値の平均(データとして使ったものには○印をする)
4回目: 7.80 ml
5回目: (なし) ml 平均適下量: 7.80 ml
○10倍希釈食酢溶液のモル濃度を計算しなさい。(有効数字3桁で)
(計算式)
1×(0.09292×7.80)/1000=1×(y×10)/1000
y=0.07247...≒0.0725 10倍希釈食酢溶液の濃度: 0.0725 mol/l
(4)(3)の値より、元の食酢のモル濃度を求めなさい。
(計算式)
0.0725×10=0.725 0.725 mol/l
(5)元の食酢の密度を1.01g/mlとしたとき、食酢中の酢酸の重量パーセント濃度を求めなさい。
(60.05×0.725)/(1.01×1000)=0.043105...
0.043105...×100=4.31 4.31 %
問題
(1)1.2mol/lの塩酸20mlを、0.4mol/lの水酸化カルシウム水溶液で中和するには何ml必要か。
1×1.12×20/1000=2×0.4×x/1000
x=30 30 ml
(2)2.4mol/lの塩酸の密度は1.06g/cm3である。質量パーセント濃度を求めなさい。H=1,Cl=35.5 (小数第2位を四捨五入し、小数第1位で答えなさい)
(2.4×36.5)/(1.06×1000)=0.08264...×100=…≒8.3 8.3 %
◎適定曲線に関して
(1)略。表の数値をそのままグラフにプロットして線を引いてグラフを完成させるだけ。

(2)(1)に同じ。
(3)グラフを完成させ、「酢酸-水酸化ナトリウム」中和に指示薬としてフェノールフタレインを使用した理由は何故でしょう。説明しなさい。
フェノールフタレインはpH8.4~9.8で赤色になり、酢酸-水酸化ナトリウムの中和点がおよそpH8.4~9.6の間にあるから。
○問題
以下の「塩-塩基」の組み合わせの適定①②③④で、使用できる指示薬を(a)(b)で答えなさい。ただし、両方使用してもよい場合は「両方」と答えなさい。
なお、各指示薬の変色域は以下の通りです。
(a)メチルオレンジ(黄色 pH3.1~pH4.4 赤色)
(b)フェノールフタレイン(無色 pH8.0~pH9.8 赤色)
①塩酸-アンモニア水…a ②硝酸-水酸化カリウム…両方
③酢酸-水酸化カリウム…b ④塩酸-水酸化ナトリウム…両方
br→
main_box