
嬥懏偼揹夝幙偺悈梟塼偵偲偗弌偡偲梲僀僆儞偲側傝傑偡丅
庬椶偵傛偭偰僀僆儞偵側傝傗偡偄傕偺丄側傝偵偔偄傕偺偑偁傝丄偦偺弴斣偼僀僆儞壔孹岦偲屇偽傟傑偡丅嬥懏傪僀僆儞偵側傝傗偡偄弴斣偵側傜傋偰傒傑偡丅
偙偺弴斣傪妎偊偰偍偔偲墫巁偵偲偗傞偐偳偆偐傕傢偐傝丄揹抮傪偮偔傞偲偒偳偪傜偑亅嬌偵側傞偐敾抐偱偒偰曋棙偱偡丅偰偄偆偐妎偊側偒傖偄偗側偄傜偟偄偱偡丅
偦偙偱丄桳柤側妎偊曽乽戄偦偆偐側丂傑偀偁偰偵偡傫側丂傂偳偡偓傞庁嬥乿
揹抮偺揹嬌偵偡傞俀庬椶偺嬥懏偼丄嵍偵偁傞傎偆偑亅嬌丄塃偵偁傞傎偆偑亄嬌偲側傝傑偡丅仸悈慺偼嬥懏偱偼偁傝傑偣傫偑丄嬥懏偲摨偠偔梲僀僆儞偲側傝丄偄偄傔傗偡偵側傞偺偱嬥懏偺僀僆儞壔孹岦偺楍偵摿暿偵嶲壛偟偰偄傑偡丅
偄偭傁傫偵僀僆儞壔孹岦偺戝偒偄嬥懏傎偳壔妛曄壔偟傗偡偄偱偡丅
仚偍偝傜偄
仠僀僆儞壔孹岦偑戝偒偄偲偼丠
梲僀僆儞偵側傝傗偡偄仺揹巕傪曻弌偟傗偡偄仺巁壔偝傟傗偡偄
仠僀僆儞壔孹岦偑彫偝偄偲偼丠
梲僀僆儞偵側傝偵偔偄仺揹巕傪曻弌偟偵偔偄仺巁壔偝傟偵偔偄
仠僀僆儞壔孹岦偑彫偝偄嬥懏僀僆儞傪娷傓悈梟塼偵僀僆儞壔孹岦偺戝偒側嬥懏扨懱傪怹偣偒偡傞偲丠
僀僆儞壔孹岦偺戝偒側嬥懏偑巁壔偝傟梟夝偟丄僀僆儞壔孹岦偺彫偝側嬥懏偑娨尦偝傟愅弌偡傞Point2丂
偆偡偄墫巁傗偆偡偄棸巁偵偲偗偰悈慺傪敪惗偡傞嬥懏偼丄僀僆儞壔孹岦偱尒暘偗傞偙偲偑偱偒傑偡丅悈慺傛傝僀僆儞偵側傝傗偡偄嬥懏偼丄悈慺偵揹巕傪偁偨偊僀僆儞壔偟傑偡丅偦偺寢壥丄悈慺偑敪惗偟傑偡丅
傑偨丄悈慺傛傝僀僆儞偵側傝偵偔偄嬥懏偼丄悈慺僀僆儞偵彑偭偰僀僆儞偵側傞偙偲偑偱偒側偄偺偱婓墫巁傗婓棸巁偲斀墳偟傑偣傫丅
|
婓墫巁傗婓棸巁偵偲偗偰悈慺傪敪惗乧乮H乯傛傝嵍偵彂偐傟偨嬥懏 婓墫巁傗婓棸巁偲斀墳偟側偄丂丂丂丂乧乮H乯傛傝塃偵彂偐傟偨嬥懏 |
嬻婥拞丄傆偮偆偺壏搙偱
|
K乣Na丂 乧撪晹傑偱巁壔 |
Point3丂
堿僀僆儞偵傕僀僆儞偲偟偰埨掕偱偁傞搙崌偄偑偁傝傑偡丅徯夘偟偰偍偒傑偟傚偆丅
|
傑偀徻偟偔偼昞傪娵埫婰偡傟偽尒偊偰偔傞偼偢偱偡丅
僀僆儞壔孹岦偺昞
Point1
|
揹抮乮壔妛揹抮乯偵昁梫側傕偺
婓棸巁偵垷墧斅偲摵斅傪擖傟偰摫慄偱偮側偄偩傕偺偑儃儖僞揹抮
|
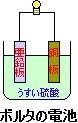 |
| 丂
[(亅)Zn仺Zn2+亄俀e-]亄[(亄)俀H+俀e-仺H2仾]亖Zn亄俀H+仺Zn2+亄H2仾 偙偺儃儖僞揹抮傪揹抮幃偱昞偡偲丂丂丂(亅)Z値乥H2SO4aq乥Cu(亄) |
Point2丂
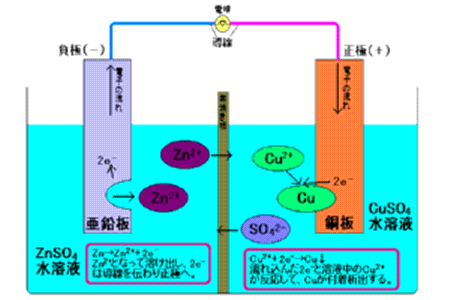
棸巁垷墧悈梟塼偵垷墧斅傪擖傟偨傕偺偲丄擹偄棸巁摵乮嘦乯悈梟塼偵摵斅傪擖傟偨傕偺偲偺娫傪慺從偒斅側偳偱巇愗偭偨揹抮傪僟僯僄儖揹抮偲偄偆丅婲揹椡偼栺1.1V偱丄偡偖偵偼掅壓偟側偄丅奺揹嬌偱偺斀墳偼師偺傛偆偵側傞丅
丂丂晧嬌乮垷墧斅乯丂Zn仺Zn2+亄2e-
丂丂惓嬌乮摵斅乯丂丂Cu2+亄2e-仺Cu伀
丂悈慺偺敪惗偑側偄偺偱丄暘嬌偼婲偙傜側偄丅
揹抮幃丂丂乮亅乯Zn乥ZnSO4aq乥CuSO4aq乥Cu乮亄乯僟僯僄儖揹抮傪挿偔巊梡偡傞偨傔偵偼
CuSO4aq偺擹搙傪擹偔丄ZnSO4aq偺擹搙傪敄偔偟偨傎偆偑椙偄丅
Point3丂
| 偙偙傑偱偱傢偐傞偙偲 |
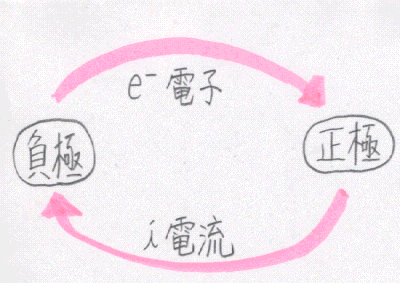
丂堦斒偵丄揹夝幙悈梟塼拞偵僀僆儞壔孹岦偺堎側傞嬥懏傪怹偡偲丄揹抮偑偱偒傞丅
僀僆儞壔孹岦偺戝偒偄嬥懏偑晧嬌丄彫偝偄嬥懏偑惓嬌偲側傞丅晧嬌偱偼巁壔斀墳丄惓嬌偱偼娨尦斀墳偑婲偙傞丅
丂揹抮偺婲揹椡偼丄椉嬌偺嬥懏偺僀僆儞壔孹岦偺嵎偑戝偒偄傎偳戝偒偄丅
儅儞僈儞姡揹抮
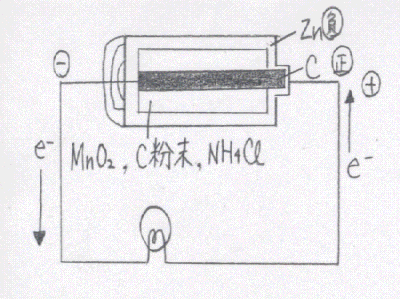
丂儅儞僈儞姡揹抮
丂(亅)丂倅値乥俶俫係俠倢aq丆倅値俠倢俀aq乥俵値俷俀丆俠丂(亄)
丂倅値仺倅値俀亄亄俀倕亅丂丂丂倅値尨巕偼巁壔偝傟偨
丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂 惗惉暔偼倫俫偵傛偭偰曄壔
丂俵値俷俀亄係俫亄亄俀倕亅仺俵値俀亄亄俀俫俀俷丂丂丂俵値尨巕偼娨尦偝傟偨
梫偼丄晧嬌偱敪惗偡傞Zn2+傪徚旓偡傞偨傔偵NH4+偲斀墳傪婲偙偝偣丄偦偺寢壥丄嘆乽僥僩儔傾儞儈儞垷墧(嘦)僀僆儞[Zn(NH3)4]2+乿偑偱偒傞丅
偝傜偵惓嬌偱偼悈慺偺敪惗傪杊偖偨傔偵丄巁壔嵻偲偟偰嘇乽巁壔儅儞僈儞(嘩)MnO2乿傪壛偊丄偐傢傝偵嘊乽悈H2O乿傪惗惉偝偣傞丅
揹抮偐傜揹壸傪庢傝弌偡偙偲傪曻揹偲偄偄丆曻揹偟偨揹抮偵曻揹偲媡偺岦偒偵揹棳傪奜晹偐傜棳偟丆揹嬌偱曻揹偲媡偺斀墳傪偍偙偡憖嶌傪廩揹偲偄偄傑偡丅
丂儃儖僞揹抮傗儅儞僈儞姡揹抮偼丆廩揹偡傞偙偲偑偱偒傑偣傫丅偙偺傛偆側揹抮傪堦師揹抮偲偄偄傑偡丅偦傟偵懳偟偰丆廩揹偵傛傝孞傝曉偟巊梡偱偒傞揹抮傪擇師揹抮傑偨偼拁揹抮偲偄偄傑偡丅
Point係
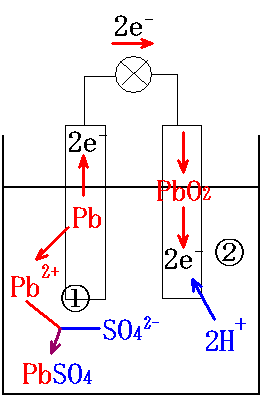
婲揹椡丗栺俀丏侾倁
晧嬌丗墧俹倐亖俀侽俈倗
丂丂丂俹倐亄俽俷42-仺俹倐俽俷4亄俀e-乮巁壔乯
惓嬌丗巁壔墧乮嘩乯俹倐俷2仺巁壔嵻偲偟偰偼偨傜偔丅
丂丂丂俹倐俷2亄係俫+亄俽俷42-亄俀e-仺俹倐俽俷4亄俀俫2俷乮娨尦乯
慡懱偱偼丄
丂丂丂俹倐亄俹倐俷2亄俀俫2俽俷4
丂丂丂乮
揹抮幃偼丄
丂丂丂乮亅乯俹倐乥俫2俽俷4 aq乥俹倐俷2乮亄乯
仠摿挜
丒棸巁墧乮嘦乯偑敀怓偺屌懱偲偟偰椉嬌斅偵晅拝偡傞丅
丂仺梟塼偼墭傟偵偔偔丄廩揹偟傗偡偄丅
丂丂椉嬌斅偺幙検偑乮惓嬌丗俀俁俋仺俁侽俁丄晧嬌丗俀侽俈仺俁侽俁乯憹壛偡傞丅
丒揹巕俀mol偑捠揹偡傞偺偵懳偟偰丄棸巁傕俀mol徚旓偝傟丄悈偑俀mol惗偠傞丅
丂仺棸巁偺擹搙偑敄偔側傞丅
丂丂仺悈梟塼偺枾搙偑彫偝偔側傞丅
廩揹偡傞偲偒偼丄晧嬌傪揹尮偺晧嬌偲丄惓嬌傪揹尮偺惓嬌偵愙懕偟偰揹棳傪棳偡丅
曻揹偡傞偲偒偼丄晧嬌傪揹尮偺惓嬌偲丄惓嬌傪揹尮偺晧嬌偵愙懕偟偰揹棳傪棳偡丅
br仺
main_box